高一離子方程式100個—高一離子方程式總結
1高中常見離子方程式
一、離子反應常見類型:
1、復分解型離子反應:例:Ag++Cl-=AgCl↓2H++CO32- =CO2↑+H2O
2、置換反應型:例:Zn+2H+=Zn2++H2 ↑ Cl2+2I-=2Cl-+I2
3、鹽類水解型:例:NH4++H2O==NH3·H2O+H+ CH3COO-+H2O ==CH3COOH+0H-
4、復雜的氧化還原型:例:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O 另外還有生成物中有絡合物時的離子反應等。
二、離子方程式書寫規則:
1、只能將強電解質(指溶于水中的強電解質)寫出離子形式,其它(包括難溶強電解質)一律寫成分子形式。如碳酸鈣與鹽酸的反應:CaCO3+2H+=Ca2++CO2↑+H2O 因此熟記哪些物質是強電解質、哪些強電解質能溶于水是寫好離子方程式的基礎和關鍵。
2、不在水溶液中反應的離子反應,不能書寫離子方程式。如銅與濃H2SO4的反應,濃H2SO4與相應固體物質取HCI、HF、HNO3的反應,以及Ca(OH)2與NH4Cl制取NH3的反應。
3、堿性氧化物雖然是強電解質,但它只能用化學方程式寫在離子方程式中。如CuO與鹽酸的反應:CuO+2H+=Cu2++H2O
4、有酸式鹽參加的離子反應,對于弱酸酸式根離子不能拆成H+和酸根陰離子(HSO4-除外)。 如NaHCO3溶液和NaOH溶液混合:HCO3-+OH-=CO32-+H2O不能寫成:H++OH-=H2O
5、書寫氧化還原反應的離子方程式時,首先寫好參加反應的離子,然后確定氧化產物和還原產物,再用觀察配平并補齊其它物質即可;書寫鹽類水解的離子方程式時,先寫好發生水解的離子,然后確定產物,再配平并補足水分子即可。
6、必須遵守質量守恒和電荷守恒定律,即離子方程式不僅要配平原子個數,還要配平離子電荷數和得失電子數。如在FeCl2溶液中通入Cl2,其離子方程式不能寫成: Fe2++Cl2=Fe3++2Cl-,因反應前后電荷不守恒,應寫成:2Fe2++Cl2=Fe3++2Cl-。
7、不能因約簡離子方程式中局部系數而破壞整體的關系量。如稀H2SO4和Ba(OH)2溶液的反應,若寫出為:Ba2++OH-+H++SO42-=BaSO4+H2O就是錯誤的,正確應為Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O。
2常見離子方程式
一、復分解反應
㈠水解反應與電離
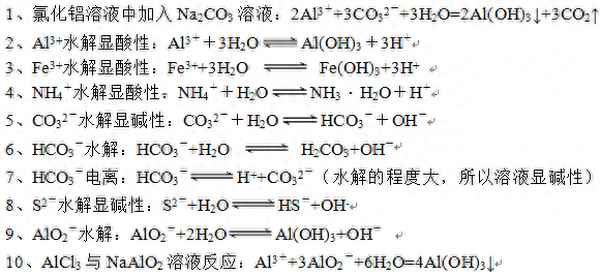
11、Al2(SO4)3與NaHCO3溶液反應:Al3++3HCO3-=Al(OH)3↓+3CO2↑
12、Al2(SO4)3與Na2CO3溶液反應:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
13、Fe(NO3)3與NaHCO3溶液反應:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑
小結:Fe3+、Al3+、AlO2-水解程度很大,很多帶有相反電性的離子不能與其大量共存,具體有: Al3+與CO32-、HCO3-、SO32-、HSO3-、S2-、HS-等均不能大量共存,混合后將生成Al(OH)3沉淀;Fe3+與CO32-、HCO3-發生反應生成Fe(OH)3沉淀和CO2氣體,與SO32-、HSO3-、S2-、HS-則發生氧化還原反應生成Fe2+,SO32-、HSO3-被氧化成SO42-;S2-、HS-被氧化成S沉淀;AlO2-水解程度較大,能與OH-反應的離子大多也能和AlO2-反應,從而生成Al(OH)3沉淀。
㈡和Al有關
14、向AlCl3溶液中加入少量的NaOH溶液:Al3++3OH-=Al(OH)3↓
15、向AlCl3溶液中加入過量的NaOH溶液:Al3++4OH-=AlO2-+2H2O
16、氯化鋁溶液中加入過量(或少量)的氨水Al3++3NH3·H2O=Al(OH)3↓+3NH4+
17、明礬溶液加氫氧化鋇至SO42-完全反應:
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
18、明礬溶液加氫氧化鋇至Al3+完全沉淀:
2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
19、Al2O3與鹽酸反應:Al2O3+6H+=2Al3++3H2O
20、Al2O3與NaOH溶液反應:Al2O3+2OH-=2AlO2-+H2O
21、Al(OH)3與HCl反應:Al(OH)3+3H+=Al3++3H2O
22、Al(OH)3與NaOH溶液反應:Al(OH)3+OH-=AlO2-+2H2O
23、向NaAlO2溶液中滴入幾滴稀鹽酸(少量):AlO2-+H2O+H+=Al(OH)3↓
24、向NaAlO2溶液中滴入過量稀鹽酸:4H++AlO2-=Al3++2H2O
㈢CO2、HCO3-、CO32-
25、NaHCO3與鹽酸反應:H++HCO3-=CO2↑+H2O
26、NaHCO3與氫氧化鈉溶液反應:HCO3-+OHˉ=CO32-+H2O
27、燒堿溶液中加入過量碳酸氫鈣溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
28、燒堿溶液中加入少量碳酸氫鈣溶液:Ca2++2HCO3-+2OH-=CaCO3↓+H2O+CO32-
29、澄清石灰水與少量小蘇打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O
30、澄清石灰水與過量NaHCO3溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
31、向次氯酸鈣溶液中通入過量的二氧化碳ClO-+CO2+H2O=HCO3-+HClO
32、向次氯酸鈣溶液中通入少量的二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
33、CaCO3與硝酸(鹽酸)溶液:2H++CaCO3=CO2↑+H2O+Ca2+
34、CaCO3與醋酸溶液:2CH3COOH+CaCO3=Ca2++2CH3COO-+CO2↑+H2O
35、Na2SiO3溶液中通入過量CO2氣體:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
36、Na2SiO3溶液中通入少量CO2氣體:SiO32-+CO2+H2O=H2SiO3↓+CO32-
37、足量的CO2通入飽和碳酸鈉溶液中:CO2+2Na++CO32-+H2O=2NaHCO3↓
38、少量的CO2通入澄清石灰水中:CO2+Ca2++2OH-=CaCO3↓+H2O
39、足量的CO2通入澄清石灰水中:CO2+OH-=HCO3-
40、向Na2CO3溶液中通入CO2:CO32-+H2O+CO2=2HCO3-
41、向Na2CO3溶液中滴入幾滴稀鹽酸(少量):H++CO32-=HCO3-
42、向Na2CO3溶液中滴入過量稀鹽酸:2H++CO32-=CO2↑+H2O
㈣其它
43、氫氧化鋇溶液與稀H2SO4反應:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
44、硫酸氫鈉溶液中加入氫氧化鋇溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
45、硫酸氫鈉溶液中加入氫氧化鋇溶液至硫酸根沉淀完全:
H++SO42-+Ba2++OH-=BaSO4↓+H2O
46、氯化鐵溶液中加過量氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
47、用膽礬溶液除去H2S氣體:H2S+Cu2+=CuS↓+2H+
48、氫氧化亞鐵溶于稀鹽酸Fe(OH)2+2H+=Fe2++2H2O
49、氫氧化鐵溶于稀鹽酸Fe(OH)3+3H+=Fe3++3H2O
50、Fe3O4被鹽酸溶解:Fe3O4+8H+=2Fe3++Fe2++4H2O
51、等體積等物質的量濃度的氫氧化鋇稀溶液與碳酸氫銨稀溶液混合
Ba2++2OH-+NH4++HCO3-=BaCO3↓+H2O+NH3·H2O
52、AgNO3溶液中滴入過量氨水:Ag++2NH3·H2O=Ag(NH3)2++2H2O(總反應式)
53、二氧化硅與氫氧化鈉溶液反應:SiO2+2OH-=SiO32-+H2O
54、硫酸氫氨與過量氫氧化鈉反應:H++NH4++2OH-=H2O+NH3·H2O
55、氨水中滴加稀鹽酸:NH3·H2O+H+=NH4++H2O
56、氨水與醋酸反應:NH3·H2O+CH3COOH=NH4++CH3COO-+H2O
57、NH4+與強堿溶液反應:①NH4++OH-=NH3·H2O;
②加熱時NH4++OH-s△NH3↑+H2O
二、氧化還原反應
㈠HNO3
58、金屬銅與稀硝酸反應:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑
59、金屬銅與濃硝酸反應:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
60、稀硝酸與少量的鐵屑反應:Fe+4H++NO3-=Fe3++NO↑+2H2O
61、稀硝酸與過量的鐵屑反應:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
62、氫氧化亞鐵溶于稀硝酸3Fe(OH)2+10H++NO3-=3Fe3++8H2O+NO↑
63、SO2通入到NaNO3溶液中:3SO2+2H2O+2NO3-=3SO42-+4H++2NO↑
64、SO32-被HNO3氧化:3SO32-+2NO3-+2H+=3SO42-+H2O+2NO↑
65、酸性條件下I-被HNO3氧化:6I-+2NO3-+8H+=3I2+4H2O+2NO↑(64、65一般不要求寫)
㈡鹵素
66、向次氯酸鈣溶液中通人過量的二氧化硫:產物有CaSO4↓、Cl-、H+
67、向次氯酸鈣溶液中通人少量的二氧化硫:產物有CaSO4↓、Cl-、HClO
68、實驗室用MnO2和濃鹽酸制取Cl2:MnO2+4H++2Cl-j△Mn2++Cl2↑+2H2O
69、用KMnO4和濃鹽酸反應制取Cl2:2MnO4–+16H++10Cl-=2Mn2++5Cl2↑+8H2O
70、電解飽和食鹽水(工業制C12)2Cl-+2H2O電解Cl2↑+H2↑+2OH-
71、Fe2O3與HI(氫碘酸)溶液反應:Fe2O3+6H++2I-=2Fe2++I2+3H2O
72、Fe3O4被氫碘酸溶解:Fe3O4+8H++2I-=3Fe2++I2+4H2O
73、Fe(OH)3與HI溶液反應2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
74、X2與水反應:X2+H2O→X-+H++HXO(X=Cl、Br、I)
75、X2與強堿溶液:X2+2OH-=X-+XO-+H2O(X=Cl、Br、I)
76、漂白粉漂白原理或漂白粉溶液中通入少量CO2:
Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
77、漂白粉溶液中通入過量CO2:ClO-+H2O+CO2=HCO3-+HClO
78、溴化亞鐵溶液中通入過量:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
79、溴化亞鐵溶液中通入少量:2Fe2++Cl2=2Fe3++2Cl-
80、溴化亞鐵和1∶1反應:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
81、加熱條件下鹵素和強堿反應:X2+6OH-△5X-+XO3-+3H2O(X=Cl、Br、I)
82、FeCl2溶液中通入Cl2:2Fe2++Cl2=2Fe3++2Cl-
83、Fe2+被Br2氧化:2Fe2++Br2=2Fe3++2Br-
84、SO2和鹵素單質反應:SO2+X2+2H2O=4H++SO42-+2X-(X=Cl、Br、I)
85、Na2SO3溶液和鹵素單質反應:SO32-+X2+H2O=2H++SO42-+2X-(X=Cl、Br、I)
86、在碘化亞鐵溶液中通入足量:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-
87、在碘化亞鐵溶液中通入少量2I-+Cl2=I2+2Cl-
㈢其它
88、Na與CuSO4溶液反應:2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑
89、電解CuSO4溶液2Cu2++2H2O電解2Cu+O2↑+4H+
90、鋁片溶于苛性鈉溶液:2Al+2OH-+2H2O=2AlO2-+3H2↑
91、銅片插入硝酸銀溶液中:Cu+2Ag+=Cu2++2Ag
92、氯化鐵和銅反應:2Fe3++Cu=2Fe2++Cu2+
93、向氯化鐵溶液中加入鐵粉:2Fe3++Fe=3Fe2+
94、鈉和冷水反應:2Na+2H2O=2Na++2OH-+H2↑
95、FeSO4酸性溶液中加過量雙氧水:2Fe2++H2O2+2H+=2Fe3++2H2O
96、酸性溶液中Fe2+被O2氧化:4Fe2++4H++O2=4Fe3++2H2O
97、Fe2+在接近中性的條件下被空氣氧化:12Fe2++6H2O+O2=8Fe3++4Fe(OH)3↓
98、Si與NaOH溶液反應:Si+2OH-+2H2O=SiO32-+2H2↑